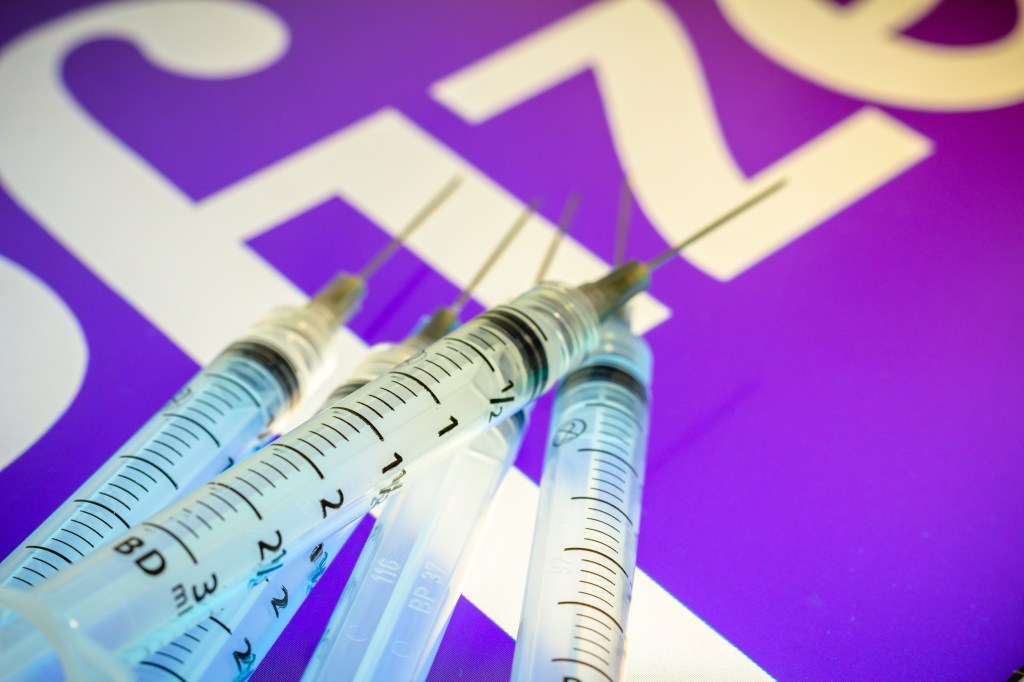
A Pfizer e a Anvisa irão se reunir na quarta-feira, 2, para discutir o pedido de registro definitivo da vacina contra Covid-19 desenvolvida pela farmacêutica em parceria com a BioNTech. A reunião tem como objetivo esclarecer a documentação necessária para início do processo. A informação foi divulgada pela CNN e confirmada por VEJA.
Após a submissão do pedido, a Anvisa tem até 60 dias para emitir seu parecer. Até o momento, apenas a Fiocruz, responsável pela produção e distribuição da vacina de Oxford-AstraZeneca no país solicitou o registro definitivo da vacina contra a Covid-19.
A Pfizer já iniciou o processo de submissão contínua na agência, que consiste no envio de dados técnicos dos estudos clínicos à Anvisa conforme forem gerados, de forma a acelerar a aprovação da vacina quando houver solicitação oficial do registro ou de autorização para uso emergencial.
A empresa já enviou à agência os dados interinos dos estudos fase 1 e 2 e dados preliminares do estudo fase 3. Em 19 de janeiro, a Anvisa emitiu o certificado de boas práticas de fabricação para a quarta e última instalações fabril utilizadas pela Pfizer para etapas de fabricação de vacinas contra a Covid-19. A etapa é fundamental para autorização dos imunizantes no Brasil.
A Pfizer poderia entrar com o pedido de uso emergencial do imunizante no país, pois conduz a fase 3 de estudos clínicos no Brasil. Mas, em dezembro, o laboratório informou que não faria a solicitação devido às exigências do processo e que continuaria com a submissão continuada.
A negociação para a compra de 70 milhões de doses da vacina contra Covid-19 desenvolvida pela Pfizer em parceria com a empresa alemã BioNTech, pelo governo federal, continua sem avanços. A farmacêutica informou que ainda aguarda uma decisão do governo brasileiro para estabelecer um contrato de fornecimento. Até o momento, o governo federal apenas assinou a carta de intenção de compra, mas não oficializou o acordo.
A vacina já está aprovada e em utilização em diversos países incluindo Estados Unidos, Canadá, Reino Unido e União Europeia. Resultados preliminares de fase 3 mostraram que a vacina tem 95% de eficácia contra a Covid-19.
- Leiam também: fase emergencial SP, com veto a cultos, futebol, praias e parques.

 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO


 Madonna esconde rótulo de cerveja, joga garrafa e patrocinador vira meme
Madonna esconde rótulo de cerveja, joga garrafa e patrocinador vira meme Madonna: participação ‘muda’ de Anitta teve motivo prévio
Madonna: participação ‘muda’ de Anitta teve motivo prévio Apresentador se demite da Globo e estreia nervoso na RedeTV
Apresentador se demite da Globo e estreia nervoso na RedeTV A razão de William Bonner usar avião da FAB para ir ao Rio Grande do Sul
A razão de William Bonner usar avião da FAB para ir ao Rio Grande do Sul O que está por trás da demissão de Claudia Raia da Globo após 40 anos
O que está por trás da demissão de Claudia Raia da Globo após 40 anos







