O pesadelo da família Whitehead começou num dia de 2010, quando Emily, então com 5 anos, recebeu um diagnóstico devastador: estava com leucemia linfoide aguda, o tipo mais comum em crianças e adolescentes e cuja taxa de mortalidade é de 15%. Emily passou por dois ciclos de quimioterapia, mas a doença, apesar do bombardeio químico, simplesmente não cedeu. Os médicos disseram então que a única saída era fazer um transplante de medula. Enquanto Emily esperava por um doador, seu câncer tornou-se ainda mais agressivo, impossibilitando o procedimento. Ela ficou fraca, emagreceu muito e perdeu os cabelos. Aos 6 anos, a vida de Emily parecia ter chegado a um epílogo antes mesmo de florescer. Seu destino estava traçado — até que seu pai soube de uma novidade notável.

No Hospital Infantil da Filadélfia, especialistas vinham testando um novo tratamento contra o câncer, exatamente do tipo que Emily tinha. Era uma iniciativa totalmente experimental. Mas o eletricista Tom Whitehead, pai de Emily, soube da experiência e conseguiu que aceitassem sua filha nos testes, embora o risco fosse altíssimo, já que a terapia nunca havia sido testada em crianças. Uma máquina removeria parte do sangue de Emily para extrair as células brancas, os leucócitos, que formam o exército de defesa do organismo. Um vírus de HIV modificado reprogramaria geneticamente as células brancas para que elas passassem a atacar o câncer. “Tínhamos duas opções: arriscar ou ir para casa e simplesmente esperar o tempo passar”, disse Tom Whitehead a VEJA. “Foi brutal assistir a tudo isso. Os médicos afirmavam que ela tinha menos de uma chance em mil de sobreviver.”

Emily Whitehead não só agarrou uma chance em mil como se tornou o símbolo de uma vitória monumental sobre o câncer — e entrou para a história da medicina. Na quarta-feira 30, a terapia que lhe salvou a vida foi aprovada pela FDA, a rigorosa agência americana que regula os remédios. A aprovação foi saudada como o que realmente é: uma revolução no tratamento contra o câncer. “Estamos desbravando uma nova fronteira de inovação médica com a capacidade de reprogramar as células do próprio paciente e atacar um câncer fatal”, disse o médico Scott Gottlieb, diretor da FDA, com um otimismo incomum nos anúncios da entidade. Para o oncologista Tim Cripe, do Nationwide Children’s Hospital, de Columbus, em Ohio, um dos centros de referência em tratamentos infantis nos Estados Unidos, “foi a coisa mais excitante que já vi em toda a minha vida”.
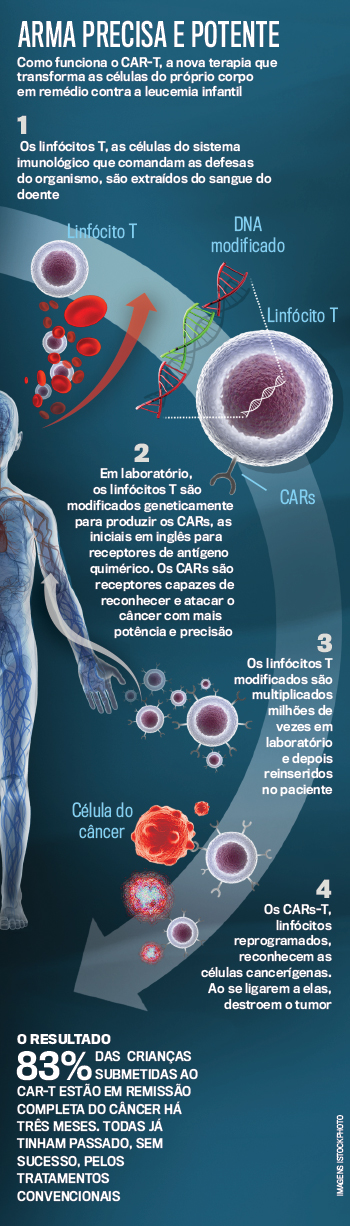
O tratamento consiste na técnica mais arrojada já empregada na oncologia mundial. Com a reprogramação das células do sangue, o próprio organismo do paciente torna-se um remédio contra o câncer, e ataca apenas as células doentes, poupando as saudáveis — ao contrário do que acontece nas sessões de quimioterapia convencional. O método é conhecido como Car-T, sigla em inglês para receptores de antígeno quimérico (veja o quadro ao lado). Os primeiros testes começaram em 2012 e, de lá para cá, os resultados apurados têm sido excelentes. Em 52 das 63 crianças e jovens com idade de 3 a 23 anos que se submeteram ao tratamento — entre eles a menina-símbolo, Emily — a leucemia desapareceu por completo. Ressalve-se que todos os pacientes, sem exceção, estavam desenganados, como se diz no jargão médico. Já haviam, portanto, passado por todas as condutas terapêuticas possíveis, sem sucesso. Diz Fernando Maluf, oncologista do Hospital Albert Einstein e da Beneficência Portuguesa, em São Paulo: “É uma técnica revolucionária, pois inaugura uma forma totalmente individual de tratar o câncer”.
O remédio aprovado pela FDA foi desenvolvido pelo laboratório suíço Novartis e é o primeiro dessa família da terapia Car-T. Seu nome comercial: Kymriah. A liberação foi concedida para o tratamento de leucemia linfoide aguda, como a de Emily. É a mais comum, e responsável por 70% das leucemias em crianças e adolescentes. Mas os especialistas apostam que, em breve, a terapia celular poderá ser aplicada no combate a outros tumores. Atualmente, há quarenta estudos sendo conduzidos para testar os efeitos do novíssimo tratamento para câncer de rim, de próstata, de intestino, de ovário e de pâncreas, entre outros. No Brasil, o Kymriah deverá chegar dentro de três anos. Estudos em adultos e idosos ainda engatinham.
Há beleza no espetacular avanço, ao reunir a manipulação genética ao uso das próprias células do sistema imunológico do paciente. A base de ação está no sistema de defesa do organismo, uma complexa orquestra composta de células e substâncias que defendem o corpo contra vírus, bactérias e outros invasores, como o câncer. Para conseguirem crescer, os tumores precisam encontrar formas de driblar as defesas do organismo e bloquear sua capacidade natural de lutar. “O objetivo primordial da imunoterapia é ajudar o sistema imunológico a reconhecer o câncer como uma ameaça e a atacá-lo”, diz Paulo Hoff, professor de oncologia da Universidade de São Paulo e diretor-geral do Instituto do Câncer do Estado de São Paulo. É exatamente o que o Kymriah faz. E isso acontece a partir da manipulação genética em laboratório. O primeiro passo é extrair uma amostra de 200 mililitros de sangue do doente. Desse material, separam-se os linfócitos T, as células que comandam a sinfonia do sistema imunológico. Em laboratório, os linfócitos T são alterados de modo a receber um receptor, o Car, uma partícula desenhada para se dirigir a um alvo específico — no caso, o CD19, uma molécula encontrada na superfície das células com leucemia linfoide aguda. O segundo passo é fazer com que os linfócitos T, já com o Car (transformado em Car-T, portanto), se multipliquem. Quando injetados de volta na corrente sanguínea, os linfócitos T poderosos reconhecem e matam as células cancerígenas. O câncer desaparece. A terapia celular está sendo chamada pelos médicos de “remédio vivo”.
É um passo extraordinário, não resta dúvida. Mas há desafios fundamentais a ser vencidos. Os três principais:
• O valor do tratamento personalizado já foi definido e é caríssimo: 475 000 dólares, o equivalente a 1,5 milhão de reais.
• Não se trata de um medicamento que se compre em farmácia — o acesso a ele se dará em hospitais, apenas. O efeito colateral da terapia não é leve. A resposta exacerbada do sistema imunológico pode causar febre muito alta e queda súbita de pressão arterial, além de dificuldade para respirar e inchaço dos órgãos. “As reações adversas podem ser graves e, por isso, o procedimento deverá ser feito com monitoramento contínuo”, diz Vladmir Cordeiro de Lima, onco-hematologista do A.C. Camargo Cancer Center, de São Paulo. Em maio, a Kite Pharma, uma das farmacêuticas americanas que também testam a técnica, revelou que uma pessoa havia morrido durante um estudo clínico por causa de um edema cerebral.
• A fabricação do Kymriah, da Novartis, é totalmente individual, lembre-se. É feita sob medida para cada paciente. Depende, portanto, de um processo extremamente complexo. Atualmente, há 32 centros capacitados para o desenvolvimento da medicação. No Brasil ainda não existe nenhum.
A trajetória do Car-T começou em 1990, quando o químico e imunologista Zelig Eshhar, do Instituto de Ciência Weizmann, em Israel, se juntou ao americano Steven Rosenberg, dos Institutos Nacionais de Saúde, nos Estados Unidos (NIH), para desenvolver as primeiras células em laboratório. Foram necessários vinte anos para fazer com que elas se multiplicassem de modo eficaz e, ao mesmo tempo, os efeitos colaterais diminuíssem. A terapia atual, da forma como está desenhada, individualíssima, só se tornou possível pela combinação dos conhecimentos científicos sobre o sistema imunológico, mas principalmente pelos avanços na manipulação genética. Em 2003, com a conclusão do Projeto Genoma, quando o DNA humano foi totalmente rastreado, deu-se o primeiro grande passo nesse sentido. Isso porque o câncer é uma doença do genoma. Para se desenvolver, é preciso que haja alguma alteração no DNA. “O entendimento das alterações na origem dessas mudanças abriu as portas para o desenvolvimento da medicina personalizada”, diz Marcelo Cruz, oncologista clínico da Divisão de Hematologia e Oncologia da Universidade Northwestern, em Chicago.
Até bem pouco tempo atrás os fundamentos para o tratamento do câncer eram baseados em três pilares: cirurgia, quimioterapia e radioterapia. Essas estratégias continuam indispensáveis para a maioria dos tumores. Os quimioterápicos, porém, como se sabe, atacam também células saudáveis. Desenvolvidas na década de 90, as chamadas terapias-alvo foram as pioneiras nas condutas mais direcionadas. O medicamento que inaugurou essa classe foi o trastuzumabe (Herceptin), aprovado nos Estados Unidos em 1998 para tumores de mama (veja histórias de pacientes tratados com medicamentos com ação específica ao longo desta reportagem). A terapia-alvo é projetada para bloquear o crescimento e a disseminação das células cancerígenas, evitando atingir as saudáveis. A imunoterapia, a base do Kymriah, o apogeu do tratamento personalizado, e que faz o próprio corpo se defender, é bem mais recente. Surgiu em 2011.

Apesar do tom evidentemente revolucionário da grande notícia, não se pode dizer, ainda, que estamos diante da bala de prata contra o câncer. As células tumorais, pela própria complexidade da doença, sempre darão um jeito de driblar os remédios, mesmo os que atuam a partir de uma alteração genética fascinante. O caminho para a cura de uma doença que mata 8,8 milhões de pessoas no mundo a cada ano é a combinação de diversas frentes de ataque. E uma delas, a mais espetacular, foi a aprovação do Kymriah, da terapia genética. É motivo de celebração universal, sem dúvida, mas especialmente na casa dos Whitehead. “Estamos vivendo um dia incrível. A decisão do FDA foi inspiradora. Estamos orgulhosos da Emily, e ela também está muito, muito contente”, disse Tom, o pai, a VEJA na noite da aprovação do novo remédio. “O que aconteceu poderá ajudar outras crianças. É a esperança para outras tantas famílias.” Em 2 de maio passado, dia do aniversário de Emily, ela acordou cedo, enfeitou a casa, em Philipsburg, na Pensilvânia, com motivos japoneses, seus prediletos, e recebeu as amigas para uma festa do pijama. Completou 12 anos e está livre do câncer há cinco anos.
Publicado em VEJA de 6 de setembro de 2017, edição nº 2546


 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO




 TV Globo cobra fortuna dos herdeiros de Fernando Vanucci
TV Globo cobra fortuna dos herdeiros de Fernando Vanucci Pela primeira vez na história, cientistas revertem a cegueira com o uso de células-tronco
Pela primeira vez na história, cientistas revertem a cegueira com o uso de células-tronco A Geração Z está trocando o Spotify por uma tecnologia retrô
A Geração Z está trocando o Spotify por uma tecnologia retrô O passado criminoso de um dos maiores campeões da música pop dos anos 80
O passado criminoso de um dos maiores campeões da música pop dos anos 80 A ‘confissão’ de Ana Luiza Guimarães no JN que resume telejornalismo atual
A ‘confissão’ de Ana Luiza Guimarães no JN que resume telejornalismo atual








