Patente do remdesivir está há cinco anos parada no INPI
Ministério da Saúde pede rapidez na avaliação da propriedade intelectual da droga e de outros 3 potenciais remédios; órgão pode liberar produção de genérico
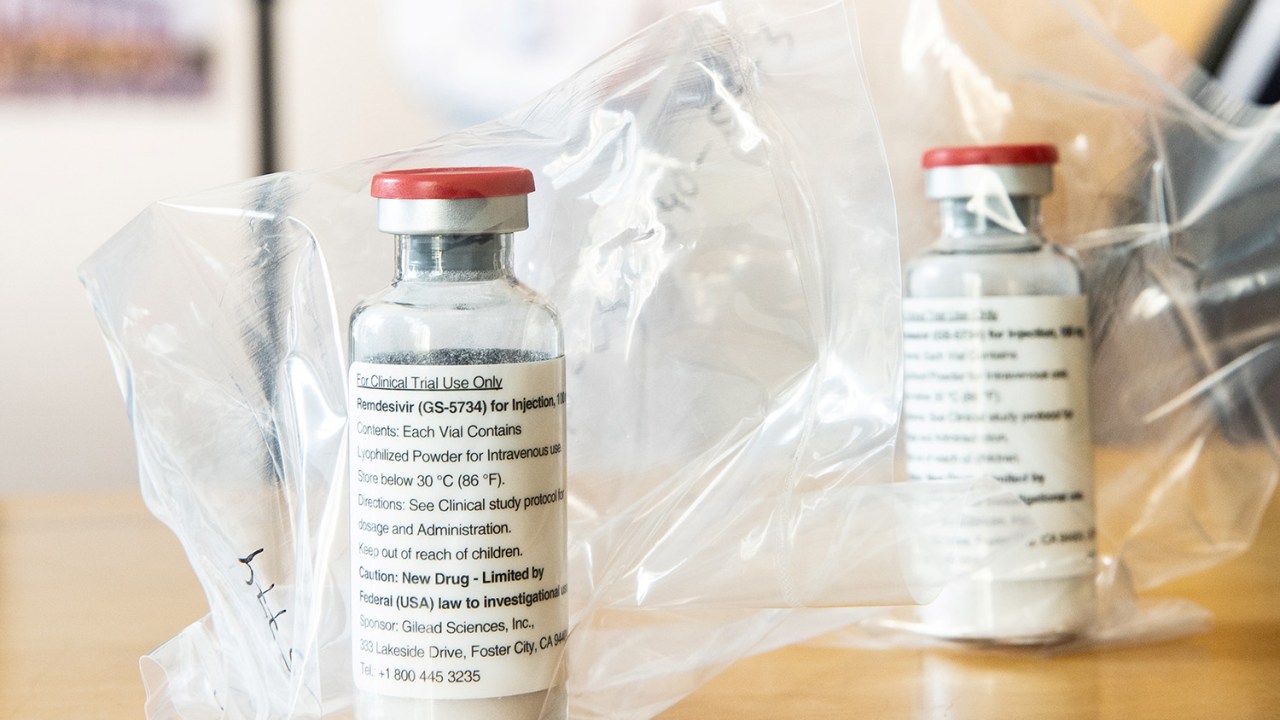
Um dos remédios mais promissores para o tratamento do novo coronavírus (Covid-19), o remdesivir, está com o exame de seu pedido de patente parado nos escaninhos do Instituto Nacional de Propriedade Industrial, o INPI, há quase cinco anos. Agora, o Ministério da Saúde pede que a análise seja acelerada. Isso pode abrir caminhos para que o remédio seja amplamente distribuído no Brasil, uma vez que, sem a patente, o governo brasileiro fica à mercê dos interesses do laboratório americano Gilead, detentor da fórmula.
VEJA obteve acesso ao processo no qual o Ministério da Saúde pede a celeridade no exame da patente. Desde 2018, o INPI possui um canal chamado trâmite prioritário — uma via rápida típica dos órgãos burocráticos brasileiros. O projeto piloto foi estendido para 2019 e, em 2020, foi adaptado para apressar possíveis tratamentos contra a Covid-19. O pedido feito pela pasta, ainda sob a gestão de Luiz Henrique Mandetta, inclui quatro princípios ativos: além do remdesivir, estão tocilizumabe, sarilumabe e favipiravir. Todos são antivirais.
Todos os remédios estão com as análises das patentes paradas há anos. A Gilead entrou com três processos envolvendo o remdesivir entre 2015 e 2016. Na época, a droga era a mais promissora no tratamento do ebola. Este ano, foi alçada pela comunidade científica como a de maior potencial contra a Covid-19, que já matou mais de 319.000 pessoas em todo o mundo, segundo o centro de pesquisa Johns Hopkins. Em uma condição excepcional, a Gilead abriu mão da exclusividade e firmou um acordo com cinco outras empresas para fabricar e distribuir o remdesivir em 127 países. O Brasil, cujo presidente Jair Bolsonaro acredita que a cloroquina e a hidroxicloroquina, sua versão suavizada, são a saída, ficou de fora. As outras drogas têm processos ainda mais antigos. O favipiravir possui um pedido de patente protocolado pela fabricante japonesa Toyama Chemical sendo avaliado desde 1999.

No ofício encaminhado por Denizar Vianna Araújo, então secretário Ciência, Tecnologia e Inovação do Ministério da Saúde, a Claudio Furtado, presidente do INPI, o ministério pede “a avaliação excepcional daqueles pedidos de patentes que sejam considerados de total relevância para garantir a saúde pública nesse momento de enfrentamento da pandemia estabelecida pelo coronavírus Covid-19”. Demorou tanto para que INPI se posicionasse que nem o secretário, muito menos o ministro, receberam a resposta. Foi Nelson Teich, substituto de Mandetta, que recebeu o retorno de Furtado, encaminhado por sua chefe de gabinete, Ana Paula Gomes Pinto, de que o órgão recebeu a documentação necessária para avaliar a súplica feita pelo ministério. Agora a cobrança ficará a cargo do próximo ministro, uma vez que Teich também decidiu deixar o órgão.
O interesse maior na apreciação das patentes é que, independentemente da decisão do INPI, de aprová-las ou não, o medicamento poderá ser disponibilizado — o que ainda não é garantido. Enquanto a patente não é emitida, o laboratório se expõe a um grande risco de ter sua propriedade intelectual roubada e pode ignorar o mercado brasileiro. A Gilead conseguiu a patente em mais de setenta países desde o desenvolvimento da droga.
A demora na avaliação dos pedidos é um problema crônico do Brasil. Em julho do ano passado, Carlos da Costa, secretário especial de Produtividade, Emprego e Competitividade do Ministério da Economia, afirmou que o número de pedidos para concessão de patentes atingia 160 mil processos e que o tempo médio para a aprovação de cada um deles era de onze anos. “Nós temos patentes sendo avaliadas que foram depositadas há onze anos. Uma tecnologia, na era digital, quando tudo é muito rápido, já não é mais tão relevante assim depois de onze anos”, disse ele na ocasião. A despeito de mais confirmações sobre a eficácia do uso do remdesivir como melhor tratamento contra a Covid-19, nenhum paciente tem onze anos para esperar pela liberação de uma medicação.

Dados os dois cenários possíveis — aprovar ou não —, alguns desdobramentos podem se suceder. No caso de rejeição do pedido de patente, a fórmula do medicamento cai em domínio público e pode ser replicada por qualquer laboratório regido pelas leis brasileiras para a produção de medicamentos genéricos. Na outra hipótese, de aprovação, a Gilead ganha o direito de exploração monopolística por vinte anos. Mas, mesmo assim, há uma possibilidade de o governo garantir a distribuição do medicamento, ignorando os desejos da farmacêutica. O governo poderia acionar o artigo 71 da lei nº 9.279, de 14 de maio de 1996, a que rege a Propriedade Intelectual e que diz: “Nos casos de emergência nacional ou interesse público […] poderá ser concedida, de ofício, licença compulsória, temporária e não exclusiva, para a exploração da patente, sem prejuízo dos direitos do respectivo titular”. Ou seja, o governo pode “quebrar” a patente de forma temporária e distribuir a fórmula para laboratórios de sua escolha, como a FioCruz.
No processo encaminhado pelo Ministério da Saúde, o órgão não dá sinais de que deseja um resultado ou outro. O parecer escrito por Luciene Ferreira Gaspar Amaral, especialista em propriedade intelectual da pasta, apenas esclarece a importância de uma decisão por parte do INPI. “Pelo exposto, comprovada a questão de Saúde Pública e o potencial caráter estratégico no âmbito do SUS quanto aos medicamentos Remdesivir, Tocilizumabe, Sarilumabe e Favipiravir, por surgirem como tecnologias promissoras no horizonte tecnológico, bem como dos princípios ativos utilizados em suas formulações e, considerando que a apresentação de pedido de patente ao INPI gera expectativa de direito monopolístico com impacto no preço do produto, fica evidenciada a necessidade de proceder ao exame prioritário dos pedidos de patente depositados nesse Instituto”, diz ela na Nota Técnica do Ministério da Saúde encaminhada ao INPI.
Todo esse vaivém, contudo, é o retrato da burocracia brasileira. Como comparação, nos Estados Unidos, foram necessárias poucas semanas para que a Anvisa americana (Food and Drug Administration, a FDA), liberasse, em caráter emergencial, o uso do remdesivir para o tratamento de pacientes com Covid-19. Imagine se a epidemia de ebola, que deixou boa parte da África de joelhos entre 2013 e 2016 tivesse desembarcado no Brasil, assim como o novo coronavírus. Dificilmente o remdesivir teria sido liberado a tempo para ajudar no tratamento das pessoas doentes. Segundo um balanço do INPI, foram feitas 64 solicitações ao Instituto para inclusão no trâmite prioritário, sendo que 46 delas foram aceitas. Destas, 23 foram encaminhadas à Anvisa num processo anterior à da análise da emissão da patente. Ou seja, desde o início da pandemia, nenhuma solicitação do ministério se transformou em um novo princípio ativo pronto para ser comercializado ou distribuído na rede de saúde.




 Galvão Bueno tem contas penhoradas por dívida milionária de vinícola
Galvão Bueno tem contas penhoradas por dívida milionária de vinícola Shopping se manifesta sobre ‘calote’ de Taís Araújo
Shopping se manifesta sobre ‘calote’ de Taís Araújo Mais um dia na vida de Elon Musk: ações da Tesla caem, carros encalham
Mais um dia na vida de Elon Musk: ações da Tesla caem, carros encalham A milionária conta dos carros blindados de Eduardo Paes no Rio
A milionária conta dos carros blindados de Eduardo Paes no Rio Interpol atende Argentina e emite alerta de prisão contra ministro do Irã
Interpol atende Argentina e emite alerta de prisão contra ministro do Irã







