Coronavírus: União Europeia autoriza remdesivir para tratar Covid-19
A aprovação é válida por um ano em todo o bloco; trata-se do primeiro medicamento autorizado na região para combater o novo coronavírus.
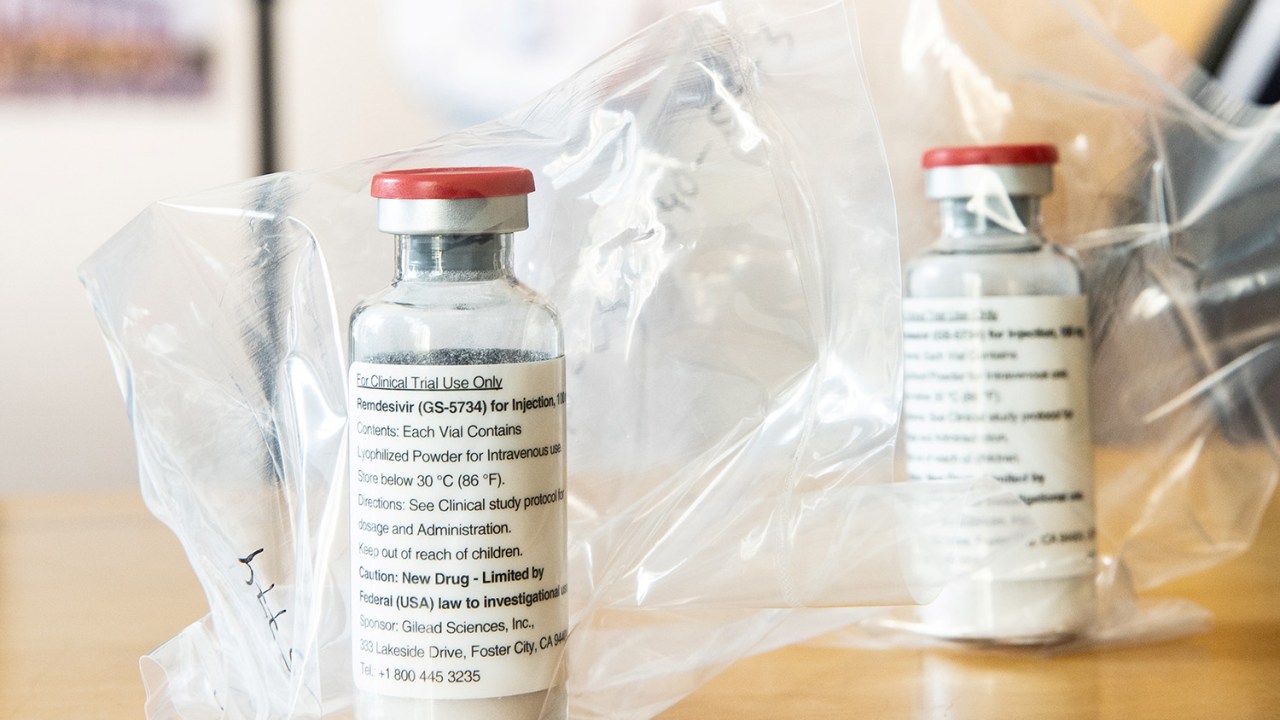
A Comissão Europeia informou nesta sexta-feira que aprovou o uso do antiviral remdesivir para tratar casos graves de Covid-19 após um acelerado processo de revisão. Trata-se do primeiro medicamento autorizado na região para combater o novo coronavírus.
A medida ocorre apenas uma semana após a Agência Europeia de Medicamentos (EMA) aprovar o medicamento, produzido pela farmacêutica Gilead Sciences, para uso em adultos e adolescentes a partir dos 12 anos de idade, que também sofrem de pneumonia e requerem suporte de oxigênio.
“Não deixaremos pedra sobre pedra em nossos esforços para garantir tratamentos ou vacinas eficientes contra o coronavírus”, disse Stella Kyriakides, comissária da União Europeia para Saúde e Segurança Alimentar, em comunicado.
A Comissão informou na quarta-feira que estava em negociações com a Gilead para obter doses de remdesivir para os 27 países do bloco.
No entanto, isso pode ser difícil depois que o Departamento de Saúde dos Estados Unidos anunciou que havia garantido toda a produção projetada da Gilead para julho e 90% da produção para agosto e setembro.
O remdesivir está sob alta demanda depois que o medicamento administrado por via intravenosa ajudou a reduzir o tempo de recuperação hospitalar em um ensaio clínico. Acredita-se que seja mais eficaz no tratamento de pacientes com Covid-19 em estágios iniciais da doença do que outras terapias, como o esteróide dexametasona.
ASSINE VEJA

Ainda assim, como o remdesivir é administrado por via intravenosa por um período de ao menos cinco dias, seu uso tem sido restringido a pacientes doentes o suficiente para demandar hospitalização.
A autorização condicional de introdução no mercado é um dos mecanismos reguladores da UE criados para facilitar o acesso precoce a medicamentos que respondem a uma necessidade médica não atendida, incluindo aqueles para situações de emergência em resposta a ameaças à saúde pública, como a atual pandemia, informou a Comissão.
A aprovação é válida por um ano no bloco e pode ser estendida ou convertida em uma autorização de comercialização incondicional, se todos os dados necessários estiverem disponíveis sobre sua eficácia e efeitos colaterais.
Com Reuters


 Shopping se manifesta sobre ‘calote’ de Taís Araújo
Shopping se manifesta sobre ‘calote’ de Taís Araújo Ivanir dos Santos entra com representação contra Ludmilla: ‘É crime’
Ivanir dos Santos entra com representação contra Ludmilla: ‘É crime’ Mulher de Jeff Bezos quebra protocolo em festa na Casa Branca
Mulher de Jeff Bezos quebra protocolo em festa na Casa Branca Dívida de Taís Araújo em condomínio vira caso de Justiça
Dívida de Taís Araújo em condomínio vira caso de Justiça Os achados da nova rodada de escavações no sítio arqueológico de Pompeia
Os achados da nova rodada de escavações no sítio arqueológico de Pompeia