Anvisa autoriza uso emergencial de vacinas contra a Covid-19
Medida tem caráter temporário e experimental e será realizada mediante solicitação das empresas
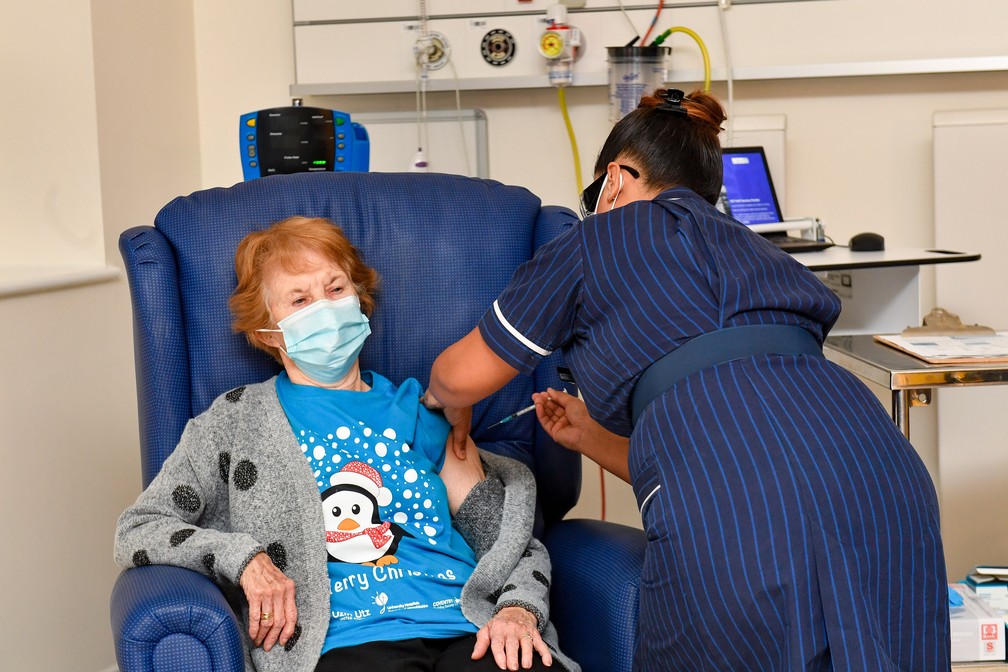
Em decisão unânime, a Anvisa oficializou nesta quinta-feira, 10, a possibilidade de concessão de autorização temporária de uso emergencial de vacinas contra a Covid-19. A medida tem caráter experimental e regras específicas para que empresas solicitem a autorização.
Na prática, isso significa que as vacinas poderão ser usadas no Brasil antes da finalização da fase 3 de estudos clínicos e do registro final. As normativas vigentes da Anvisa até então não previam a Autorização de Uso Emergencial para vacinas ou qualquer outro medicamento no país. Esse tipo de autorização já foi concedida pelo Reino Unido e Canadá para a vacina da Pfizer e e está em avaliação pelos Estados Unidos e União Europeia.
“A autorização de uso emergencial é um mecanismo que pode facilitar a disponibilização e o uso das vacinas contra Covid-19, ainda que não tenham sido avaliadas sob o crivo do registro, desde que cumpram com os requisitos mínimos de segurança, qualidade e eficácia”, disse Alessandra Bastos Soares, diretora da Anvisa.
Para que haja autorização, as empresas fabricantes precisam entrar com a solicitação, o que não foi feito por nenhuma empresa até o momento, segundo a Anvisa. “A vacina só terá autorização de uso emergencial e experimental se houver o pleito realizado por alguma empresa”, ressaltou Alessandra.
As regras para o pedido de uso emergencial de vacinas contra a Covid-19 foram publicadas pela Anvisa em 2 de dezembro e incluem: o pedido de liberação só será possível para vacinas que estão em testes no Brasil; a autorização poderá ser modificada, suspensa ou cancelada a qualquer momento, com base em elementos técnicos e científicos; serão avaliados dados de estudos clínicos e pré-clínicos e
A Anvisa também irá avaliar qualidade e boas práticas de fabricação, assim como estratégias de monitoramento e controle. A autorização para uso emergencial só permite a distribuição da vacina no sistema público de saúde e no público cuja faixa etária foi testada nos estudos. A comercialização só será liberada após o registro sanitário do produto no país.
Os imunizantes que estão em fase de testes no país atualmente são: vacina da Universidade Oxford em parceria com a AstraZeneca; imunizante da Pfizer em parceria com a BioNTech; vacina da Janssen (Johnson & Johnson) e a Coronavac.

 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO


 Premiê ucraniano diz que haverá Terceira Guerra Mundial se Rússia vencer
Premiê ucraniano diz que haverá Terceira Guerra Mundial se Rússia vencer A mais longa das noites: países árabes cooperaram com Israel contra Irã
A mais longa das noites: países árabes cooperaram com Israel contra Irã Corrupção leva CNJ a avaliar plano de intervenção no Judiciário da Bahia
Corrupção leva CNJ a avaliar plano de intervenção no Judiciário da Bahia Elon Musk: quando a liberdade de expressão encontra a fantasia
Elon Musk: quando a liberdade de expressão encontra a fantasia Filho de Renata Lo Prete diz como se inspira nos horários notívagos da mãe
Filho de Renata Lo Prete diz como se inspira nos horários notívagos da mãe