Anvisa adia discussão sobre liberação de autoteste para Covid-19
Diligências junto ao Ministério da Saúde devem ser realizadas e nova análise pode ser feita em até 15 dias
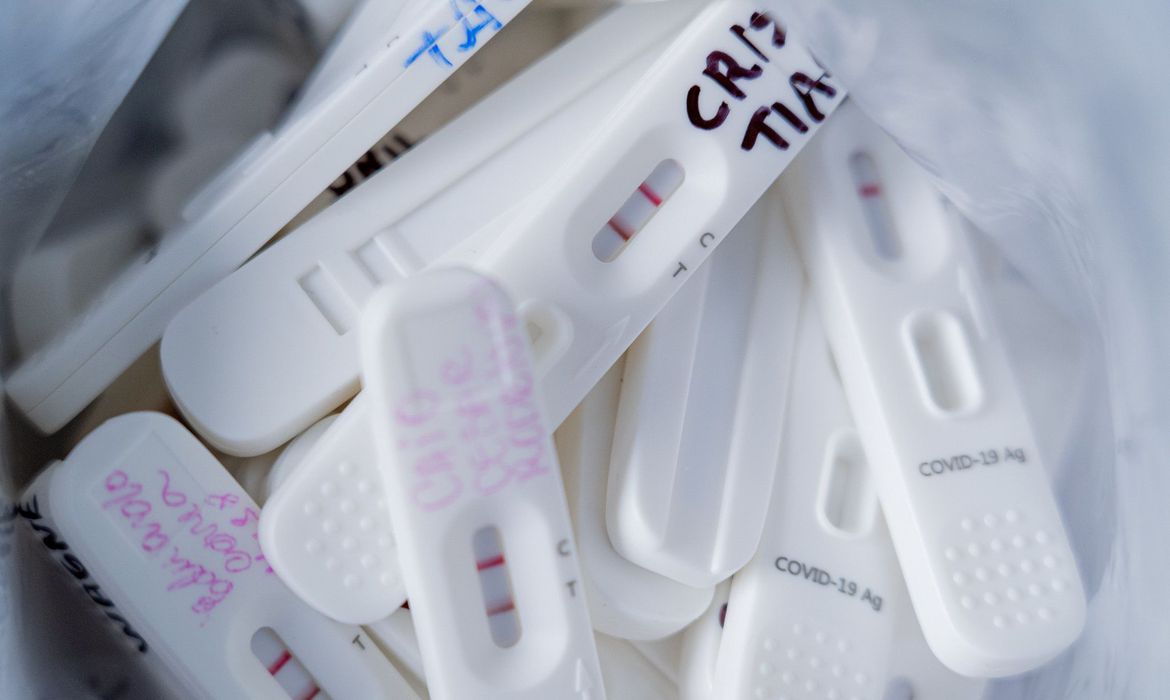
A Agência Nacional de Vigilância Sanitária (Anvisa) adiou a discussão para definir se libera ou não o uso dos autotestes de Covid-19 no Brasil. A decisão foi tomada em reunião da Diretoria Colegiada, por quatro votos a um, nesta quarta-feira, 19. O prazo para uma nova análise deve ser de até 15 dias e, durante esse período, serão realizadas diligências junto ao Ministério da Saúde para solicitar mais informações sobre o estabelecimento de uma política pública para uso dos testes.
Na última quinta-feira, 13, o Ministério da Saúde solicitou à agência que o teste, que pode ser feito em casa, fosse autorizado.
Este tipo de exame não necessita de acompanhamento de um profissional para a realização e é uma estratégia adotada nos Estados Unidos e no Reino Unido. Em seu pedido, o ministério informou que o autoteste seria uma medida complementar para triagem e isolamento de pessoas infectadas pelo novo coronavírus.
Diretora da Terceira Diretoria da Anvisa, Cristiane Rose Jourdan explicou que a nota técnica enviada pelo ministério ao órgão foi analisada e não foi reconhecida como uma formalização de política pública, requisito para a regulamentação do uso do produto no país. Mesmo assim, avaliou que o mecanismo poderia ser criado por causa do avanço da pandemia no país.
“Diante da urgência de saúde pública, tal regulamentação pode ser editada em regime de excepcionalidade para identificar e minimizar a transmissão da nova variante ômicron.”
Cristiane abordou a preocupação com a correta execução dos testes, para evitar resultados falso-negativos ou falso-positivos, e também com o registro de casos da doença, tendo em vista que a Covid-19 é de notificação compulsória.
O diretor Rômison Rodrigues Mota, da Quarta Diretoria, sugeriu que fosse realizada uma diligência e que a discussão fosse retomada em um prazo de até 15 dias. O voto foi seguido pelos demais diretores, Alex Machado Campos e Meiruze Sousa Freitas, e pelo diretor-geral da agência, Antonio Barra Torres.
“Uma aprovação nesses moldes, pura e tão somente, forneceria a possibilidade de acesso a uma ferramenta de triagem que precisaria, a reboque, de uma política pública”, disse o diretor-presidente da Anvisa, Antonio Barra Torres.
Entre as questões a serem respondidas, estão: como será feita a compilação de dados, a transformação desses dados em notificação, onde os testes poderiam ser realizado e o fluxo dos pacientes positivos, que teriam de recorrer a outros locais para que a notificação fosse concluída.

 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO

 Premiê ucraniano diz que haverá Terceira Guerra Mundial se Rússia vencer
Premiê ucraniano diz que haverá Terceira Guerra Mundial se Rússia vencer A mais longa das noites: países árabes cooperaram com Israel contra Irã
A mais longa das noites: países árabes cooperaram com Israel contra Irã Corrupção leva CNJ a avaliar plano de intervenção no Judiciário da Bahia
Corrupção leva CNJ a avaliar plano de intervenção no Judiciário da Bahia Filho de Renata Lo Prete diz como se inspira nos horários notívagos da mãe
Filho de Renata Lo Prete diz como se inspira nos horários notívagos da mãe O curioso elogio a Wagner Moura em ‘Guerra Civil’, segundo americanos
O curioso elogio a Wagner Moura em ‘Guerra Civil’, segundo americanos