A edição da vida
Pesquisadores americanos realizam o feito histórico de eliminar uma doença hereditária em embriões. Mas até que ponto podemos interferir na evolução humana?
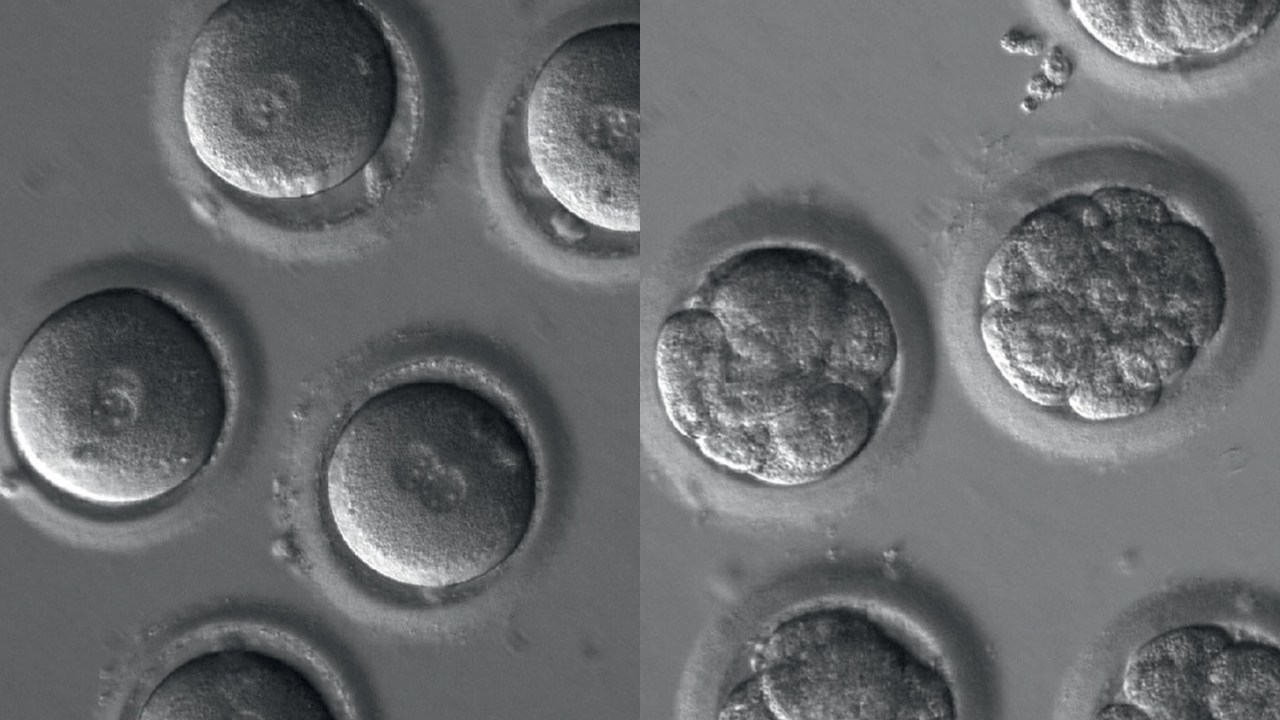
Desde o mapeamento do DNA humano, ocorrido há duas décadas, a comunidade científica mundial não era chacoalhada com tanto estardalhaço. Um estudo publicado na semana passada na prestigiosa revista Nature mostrou ser possível eliminar uma doença hereditária em embriões humanos. Pesquisadores da Universidade de Saúde e Ciência de Oregon, nos Estados Unidos, editaram os genes de células em formação para corrigir a mutação genética causadora da cardiomiopatia hipertrófica — grave doença associada à falência cardíaca e à morte súbita, mal que atinge uma em cada 500 pessoas. Os embriões manipulados não foram implantados no útero porque não há autorização legal para isso. No entanto, tinham potencial para se desenvolver e se tornar bebês livres da doença. Bebês que, na teoria, não transmitiriam cardiomiopatia hipertrófica aos seus descendentes.

O resultado da pesquisa foi recebido com extraordinário entusiasmo. A bioquímica Jennifer Doudna, criadora de uma técnica de edição genômica que viabilizou a experiência, lembrou-se da frase que o astronauta Neil Armstrong disse ao pisar pela primeira vez na Lua. “Parece um pouco com ‘um pequeno passo para um homem, mas um grande salto para a humanidade’ ”, disse Jennifer, ao festejar o anúncio do sucesso do experimento. Na prática, uma vida foi editada. Ou, sob os olhos dos que têm fé, brincou-se de Deus.
Os cientistas da Universidade de Oregon, em colaboração com outros centros reputados, como o Laboratório de Expressão Genética, na Califórnia, e a Universidade de Seul, na Coreia do Sul, aplicaram uma técnica de edição genética conhecida como CRISPR-Cas9 (pronuncia-se crísper). O método é capaz de reparar as falhas em embriões criados por meio de fertilização in vitro. O CRISPR-Cas9 é, na verdade, uma substância de reação de defesa imunológica natural das bactérias, que deu nome à técnica. Uma versão sintética foi desenvolvida em laboratório de forma a ser capaz de encontrar trechos específicos do código genético e editar (ou refazer) o DNA em locais precisos. No caso do experimento de Oregon, ele corrigiu um trecho de DNA responsável pela doença cardíaca. Os pesquisadores usaram o esperma de um voluntário com cardiomiopatia hipertrófica, uma enfermidade hereditária causada por um defeito no gene MYBPC3. A doença faz com que as paredes dos ventrículos se tornem espessas e rígidas, o que dificulta o bombeamento de sangue. O risco de complicações é aumentado quando o órgão bate de forma acelerada, como durante um exercício físico. Por isso, a doença pode levar à morte súbita, principalmente em jovens atletas.
Para compreender o refinamento e a complexidade do procedimento, é necessário lembrar-se de uma informação das aulas de biologia da escola. O DNA é o código genético que determina as características da espécie. Ele é representado pelos pares de “letras químicas” A, T, C, G, que seguem uma ordem específica. O esperma com o defeito que causa a doença cardíaca em questão tinha uma falha nessa sequência: faltavam quatro letras químicas, G, A, G, T. A técnica funcionou da seguinte forma: utilizaram-se os espermatozoides com a mutação para fertilizar os ovócitos (as células que dão origem aos óvulos) de doze mulheres saudáveis. Junto com o material masculino, que carregava a doença, os cientistas injetaram o CRISPR-Cas9, que localizou a mutação responsável pela doença do coração — e corrigiu-a. De acordo com os resultados, dos 58 embriões testados, 72% ficaram livres da mutação. Ou seja, eram absolutamente saudáveis.
O método criado pela bioquímica Jennifer Doudna começou a ser estudado há cinco anos e já acumula mais de 300 artigos, publicados por cientistas de várias partes do mundo. Em 2015, a revista Science elegeu o CRISPR-Cas9 como um dos maiores avanços científicos do ano. Não foi a primeira vez que cientistas tentaram usar o CRISPR para editar embriões humanos. Pesquisadores chineses o fizeram duas vezes: uma em 2015 para modificar um gene ligado ao distúrbio sanguíneo chamado talassemia e a outra em 2016, para tornar os genes resistentes ao HIV. Mas esses dois experimentos, além de menores, apresentaram resultados ruins e duvidosos. O caso de agora consolida o sucesso — e abre todo um bravo mundo novo para a ciência genética.
A técnica tem potencial para ser aplicada, dentro de algumas décadas, no combate definitivo a mais de 10 000 doenças causadas por mutações herdadas. Um exemplo seriam as mutações no gene BRCA, aquele relacionado ao aumento do risco de câncer de mama e ovário, o mesmo que fez a atriz Angelina Jolie retirá-los em cirurgias preventivas. Ou ainda doenças como Huntington, Alzheimer e fibrose cística. Outro uso em potencial, mais perto da realidade, é substituir ou ser utilizado em conjunto com outro procedimento conhecido como diagnóstico genético pré-implantacional, técnica indicada a pessoas com doenças genéticas hereditárias. Trata-se de realizar a fertilização in vitro e escolher quais embriões estão saudáveis, eliminando os doentes. Não seria como fazer sumir um problema do corpo, portanto, mas identificá-lo no embrião — o que, em si, já é muito polêmico e tem sido discutido com avidez.

O CRISPR-Cas9 é um capítulo do que se denomina ciência básica, e que está longe de poder ser utilizado no cotidiano da prática clínica. Há ainda um extenso caminho a ser percorrido para chegar a tanto. Existem desafios científicos, legais e éticos pela frente. No plano legal, há quinze países europeus que proíbem qualquer tentativa de mudar a linha germinal humana — ou seja, o que foi feito nos Estados Unidos e anunciado na semana passada. No caso, eles proíbem que o embrião seja alterado e implantado no útero de modo a gerar um bebê. Nos Estados Unidos, uma lei impede que se utilizem fundos públicos para criar embriões humanos para pesquisa. O estudo atual, por exemplo, foi financiado por empresas privadas e fundos universitários. Apesar dessas limitações legais, o meio científico já aposta que, em menos de dez anos, a linha germinal de algum bebê de verdade terá sido alterada. Isso significa que talvez um “bebê CRISPR” já esteja no horizonte — e as implicações éticas disso são monumentais.

Tão monumentais que a própria Jennifer Doudna contou em livro que, nos primórdios de seus estudos, tinha um pesadelo no qual Adolf Hitler vinha lhe perguntar sobre a nova técnica que ela estava desenvolvendo. Claramente, ela própria temia o uso explosivo que a técnica poderia ter — a eugenia nazista, por exemplo, que matava seres humanos “defeituosos”, poderia ser revivida com a correção dos defeitos ainda antes do nascimento, de modo a garantir uma “raça ariana” verdadeiramente “purificada”.

A manipulação genética é, a um só tempo, promessa e espanto. É condutora de enorme otimismo provocado por promessas estupendas e, também, um chamado ao horror despertado por fantasias eugênicas. Afinal, se é possível alterar um embrião de modo que o bebê não seja portador de uma doença, quem garante que não se mexerá no embrião para que o bebê seja mais bonito, mais forte, mais inteligente? A ciência, hoje, não é capaz de manipular um embrião com toda essa complexidade, mas esse é um caminho que, num futuro ainda distante, poderá ser percorrido. Por isso, a questão ética fervilha. Jennifer, ela mesma, mudou de posição. Era contrária à manipulação da linha germinal humana, mas hoje é favorável. Acha que antiético é ter os meios de evitar que um bebê nasça com uma doença terrível e nada fazer. Daí por que é fundamental que se decida o que a humanidade acha admissível e inadmissível nesse campo.
O grande nome por trás do feito divulgado na semana passada é Shoukhrat Mitalipov, biólogo celular. Nascido no Cazaquistão, formou-se em Moscou, na Rússia. Seu primeiro laboratório em território russo foi o único no país a estudar as células embrionárias. Hoje, é diretor do Centro de Células Embrionárias e Terapia Gênica da Universidade de Saúde e Ciência de Oregon, nos Estados Unidos. Atualmente, além do trabalho com o CRISPR-Cas9, ele é um dos poucos pesquisadores no mundo a estudar um tipo de manipulação genética, a clonagem, para melhorar a saúde das pessoas. Mitalipov foi também pioneiro em um método conhecido como embrião de três pais — duas mães e um pai . Sua inspiração para atuar na área foi o biólogo Keith Campbell, que desempenhou um papel fundamental para a clonagem da ovelha Dolly, em 1996. A técnica revolucionária é hoje utilizada de forma rotineira com outros animais.

Cada avanço científico está naturalmente associado a um passo anterior, eis aí a beleza da evolução científica. O caso de Louise Brown, nascida em julho de 1978, na Inglaterra, abriu caminhos para o CRISPR-Cas9. Louise foi o primeiro bebê de proveta do mundo. Seu nascimento foi amplamente divulgado. Robert Edwards, o responsável pelo experimento, ganhou o Nobel de Medicina em 2010. Mas, nos anos 70, chegou-se a discutir se as mulheres haviam perdido o privilégio e a exclusividade de conceber a vida humana. Na verdade, se Louise não tivesse nascido, a área da fertilização in vitro não seria o que é hoje (cerca de 5 milhões de seres humanos nasceram de reprodução assistida desde então). E o CRISPR-Cas9 não teria sido possível. Diz o geneticista Salmo Raskin, da Clínica Genetika, de Curitiba: “Há mais de duas décadas tentamos corrigir o material genético, com fracassos. É extraordinário ter dado certo. Mas o procedimento traz à tona um dos debates éticos mais interessantes que já vimos na história da ciência”.
Publicado em VEJA de 9 de agosto de 2017, edição nº 2542

 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO

 Shopping se manifesta sobre ‘calote’ de Taís Araújo
Shopping se manifesta sobre ‘calote’ de Taís Araújo Ivanir dos Santos entra com representação contra Ludmilla: ‘É crime’
Ivanir dos Santos entra com representação contra Ludmilla: ‘É crime’ A mais longa das noites: países árabes cooperaram com Israel contra Irã
A mais longa das noites: países árabes cooperaram com Israel contra Irã A morte que vai abalar ‘Renascer’ – e as diferenças para a versão original
A morte que vai abalar ‘Renascer’ – e as diferenças para a versão original Dívida de Taís Araújo em condomínio vira caso de Justiça
Dívida de Taís Araújo em condomínio vira caso de Justiça